轴手性是最重要的手性结构类型之一。轴手性配体,特别是以BINAP为代表的轴手性联芳烷结构的手性配体早已经在不对称催化中获得了广泛应用,成为合成化学家手中不可或缺的有力工具。随着越来越多的轴手性天然化合物和轴手性药物的发现,化学家们愈发认识到轴手性化合物的重要性,发展轴手性化合物的有效合成方法成为目前有机合成领域的研究热点之一。目前,轴手性化合物的合成研究还是主要集中在联芳基化合物、芳酰胺等阻旋轴手性化合物的不对称合成上。相比之下,具有刚性结构的非阻旋轴手性化合物,特别是亚烷基环烷烃类轴手性化合物的不对称催化合成,相关的报道还不多见(图1)。亚烷基环烷烃的轴手性结构中,手性相关的四个取代基分布在一个较长的虚拟轴两端,彼此相距较远,从而对合成过程中的远程立体化学控制提出了极高的要求。

图1 非阻旋轴手性化合物的主要类型及其合成挑战性
化学学院时磊教授课题组致力于发展有效的远程立体化学控制机制,以实现这类具有挑战性的手性结构的构建(Chem Catal. 2023, 3, 100697;Org. Lett. 2024, 26, 2646.)。近日,大连理工大学时磊教授和绍兴文理学院王晨教授合作在该领域又取得进展,通过钯催化烯丙酯的不对称氢解重排反应,成功实现构建了一系列非阻旋轴手性亚烷基环烷烃化合物。该反应方法显示出良好的底物适用范围,包括环己烷底物、环丁烷底物和以及氮杂双环底物均可以顺利进行不对称氢解反应,以优异的收率、对映选择性(最高99%ee)获得对应的轴手性烯烃。克级规模反应的收率有所下降但是对映选择性依然保持不变,显示出一定的实用性。
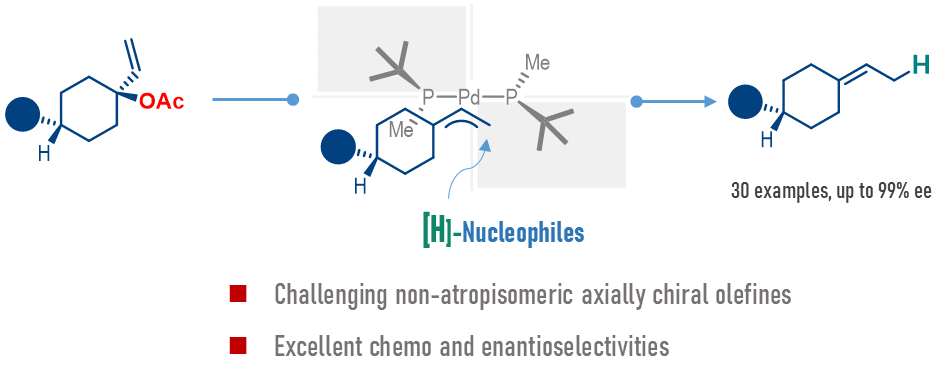
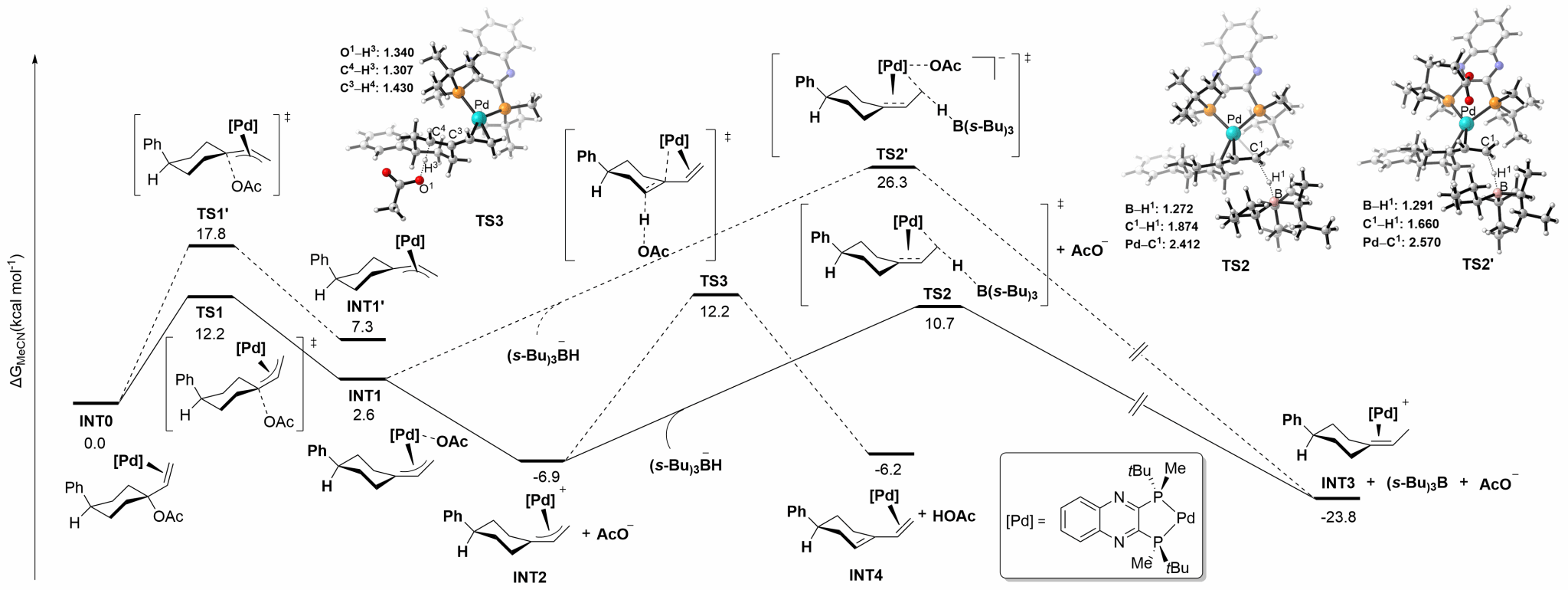
相关机理研究证明𝜂3-烯丙基钯中间体的形成是该反应的对映选择性决定步骤,此外,在该反应条件下氢解途径为能量最低的最优途径,有效避免了消除副产物的生成。
这是首次通过乙酸烯丙酯的不对称氢解实现非阻旋轴手性烯烃的合成。该方法不仅为颇具挑战性的非阻转轴手性结构提供了一种新的合成途径,而且进一步拓展了不对称氢解反应的合成潜力。该工作以“Pd-catalyzed Asymmetric Hydrogenolysis Rearrangement of Allylic Esters to Access Axially Chiral Olefins”为题发表在《Angew. Chem. Int. Ed.》上。本文的第一作者为化学学院的博士研究生邵兵茹,绍兴文理学院王晨教授和大连理工大学化学学院时磊教授为共同通讯作者,大连理工大学为第一完成单位。
原文链接:https://doi.org/10.1002/ange.202421287